Masahiro Hosaka, Ph.D.
1. 穂坂が進めていますプロジェクトの詳細
- 内分泌細胞の分泌顆粒形成機序の解明(基礎研究)
- 生体イメージングプローブの開発(国民還元型研究)
- 有機EL素材イリジウム錯体による低酸素病態イメージング技術の実用化(国民還元型研究)
- 内分泌細胞の酸素応答(基礎研究)
2. 業績
1. プロジェクトの詳細
a 内分泌細胞の分泌顆粒形成機序の解明
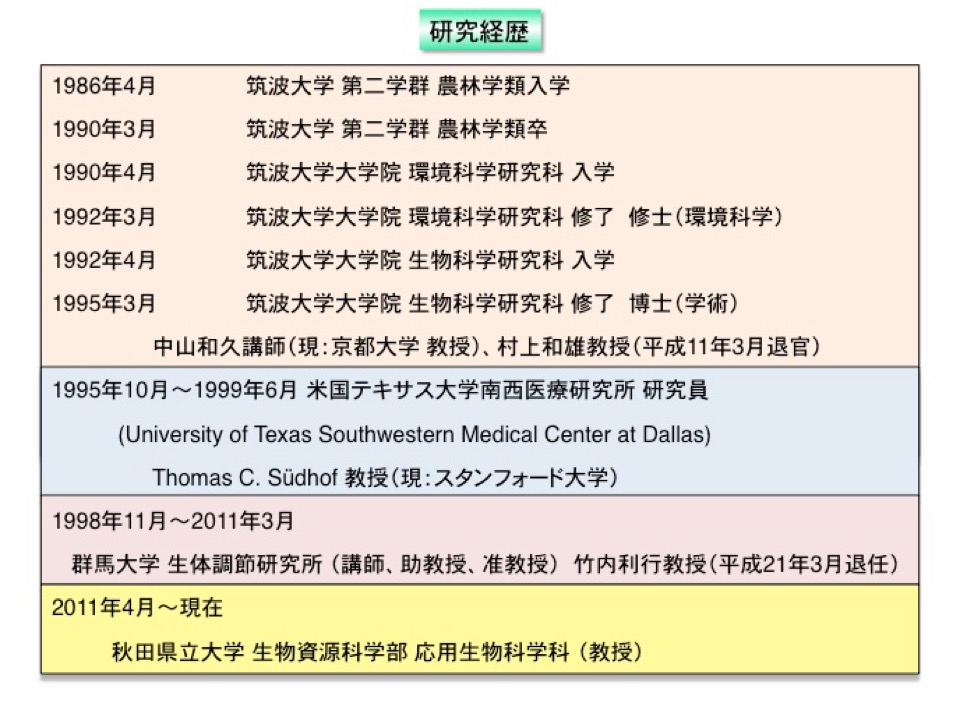
研究内容を紹介するにあたり、まず私の研究歴について紹介します。
私は、大学学部の卒業研究から現在に至るまで、一貫して内分泌系、神経系の生体情報システム制御に関して研究を行ってきました(表1)。
表1. 研究経歴
筑波大学・同大学院博士課程在学時には、中山和久講師(2024年3月 京都大学薬学部教授 ご退任)の指導のもと、『ペプチドホルモンを塩基性アミノ酸対で切断して活性化するプロセッシング酵素の探索と、そのホルモン基質に対する特異性』について研究し、世界で初めてホルモンをプロセッシングする酵素PC1/3を得て、この分野の発展に貢献しました(図1、図2; J. Biol. Chem. 266, 12127-12130, 1991; J. Biol. Chem. 265, 22075-22078, 1990; J. Biochem. (Tokyo) 109, 803-806, 1991; J. Biol. Chem. 267, 16335-16340, 1992; J. Biol. Chem. 267, 5897-5900, 1992; J. Biochem. (Tokyo) 113, 132-135, 1993; Biomed. Res. 14, 253-259, 1993)。
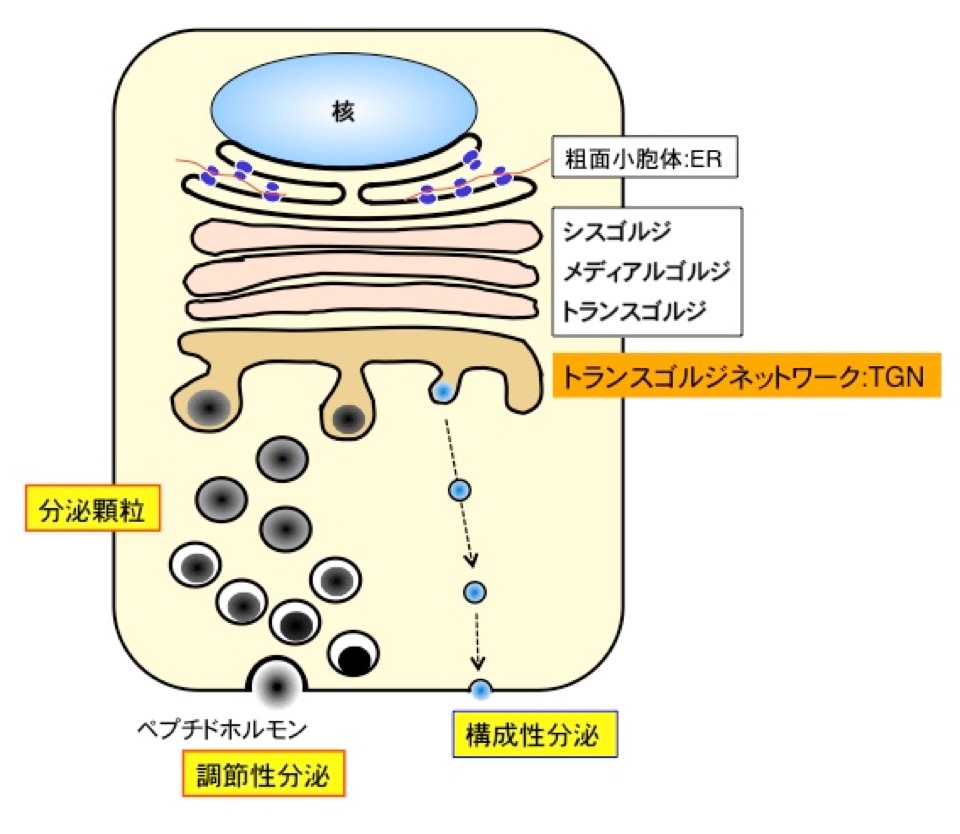
図1. 内分泌細胞のペプチドホルモンと分泌タンパク質の輸送経路。
ペプチドホルモンや神経ペプチドは、内分泌細胞の粗面小胞体で合成された後、
ゴルジ装置を経て、その出口に位置するトランスゴルジネットワーク(TGN)で
分泌顆粒に選別輸送され、細胞外刺激に応じて分泌される (調節性分泌経路)。
一方、外部刺激による調節を受けない分泌様式を構成性分泌と呼び、成長因子、膜蛋白質、
アルブミン等の血清蛋白質はこの経路によって分泌される。
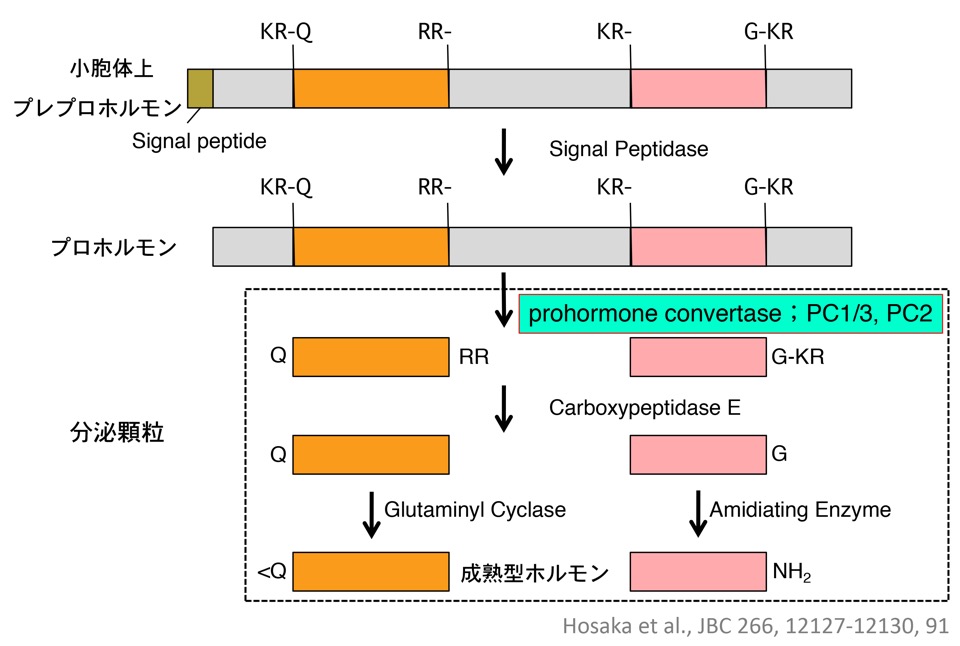
図2. ペプチドホルモンの活性化
ホルモンは分泌顆粒内で塩基性アミノ酸対でPC1/3により切断を受け活性型となる。
筑波大学卒業後はテキサス大学に留学する機会を得て、T. Südhof 教授(現 スタンフォード大学教授;2013年ノーベル賞『生理学・医学』受賞)指導のもと『シナプス小胞膜上に局在するタンパク質シナプシンの新機能』を研究しました。私は、シナプシンの三次構造を決定して<シナプシン=カルシウム調節性の二量体を形成する ATPase>仮説を導き(図3; J. Biol. Chem. 273, 1425-1429, 1998; EMBO J. 17, 977-984, 1998; J. Biol. Chem. 273, 13371-13374, 1998; J. Biol. Chem. 274, 16747-16753, 1999)、またシナプシンのリン酸化(NEURON 24, 377-387, 1999)、末梢組織におけるシナプシンの役割(Proc. Natl. Acad. Sci. 97, 9765-9770, 2000)、の解明に寄与しました。
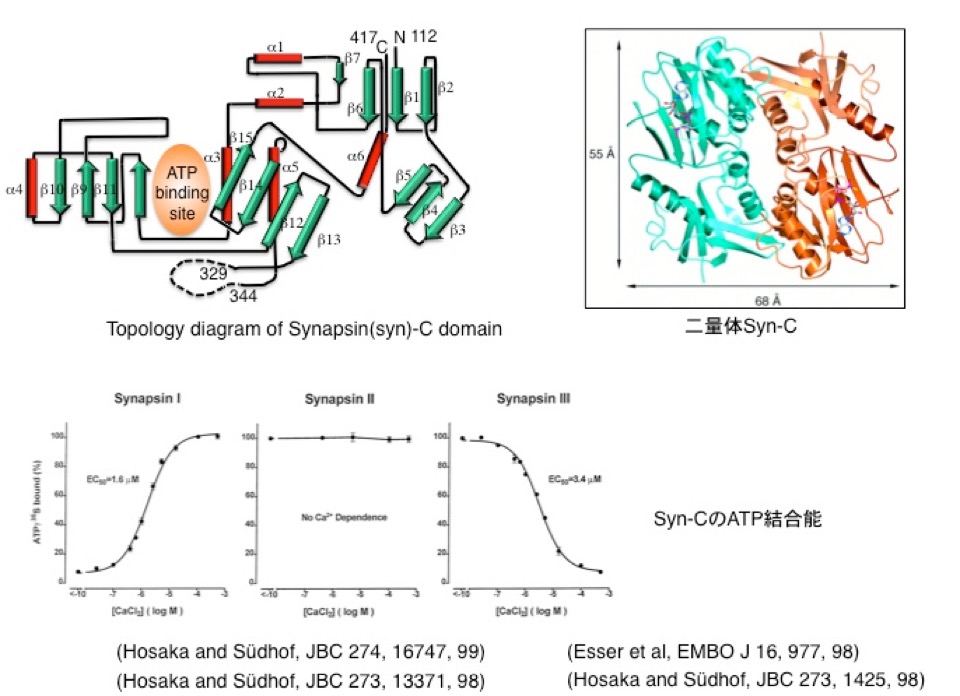
図3. シナプシン(syn)の三次構造(上)とATP結合能(下)
シナプシン I、II、IIIの ATP結合能はカルシウム濃度に対応して異なる。
群馬大学 生体調節研究所 分泌制御分野 (竹内利行 教授主催:2009年3月退任;穂坂主催:2009年4月〜2011年3月)に着任後は、当時、未解決の点が多く残されていた『内分泌細胞の分泌顆粒にペプチドホルモンが運ばれる機構』の解明を旭川医科大学の渡部教授と進めてきました(図1参照;ペプチドホルモンは分泌顆粒に運ばれて顆粒内で活性型ホルモンに変換される)。本研究で私は、顆粒内タンパク質セクレトグラニンIII(SgIII)が、高コレステロール濃度の脂質組成を持つ分泌顆粒膜(図4)と直接結合し、クロモグラニンA(CgA)とペプチドホルモンの凝集体を分泌顆粒に輸送することを明らかにしました [図5; Mol. Biol. Cell 13: 3388, 2002; J Biol Chem 279:3627, 2004; J Cell Sci 118:4785, 2005; Curr Diabetes Rev 4:31, 2008 (review); Mol Endocrinol 22:1935, 2008; Endocr J. 57:275,2010 (Review;Free PDF); Endocrinology 151, 4705-4716, 2010; Traffic 14, 205-218, 2013; Endocrinology in press 2018]。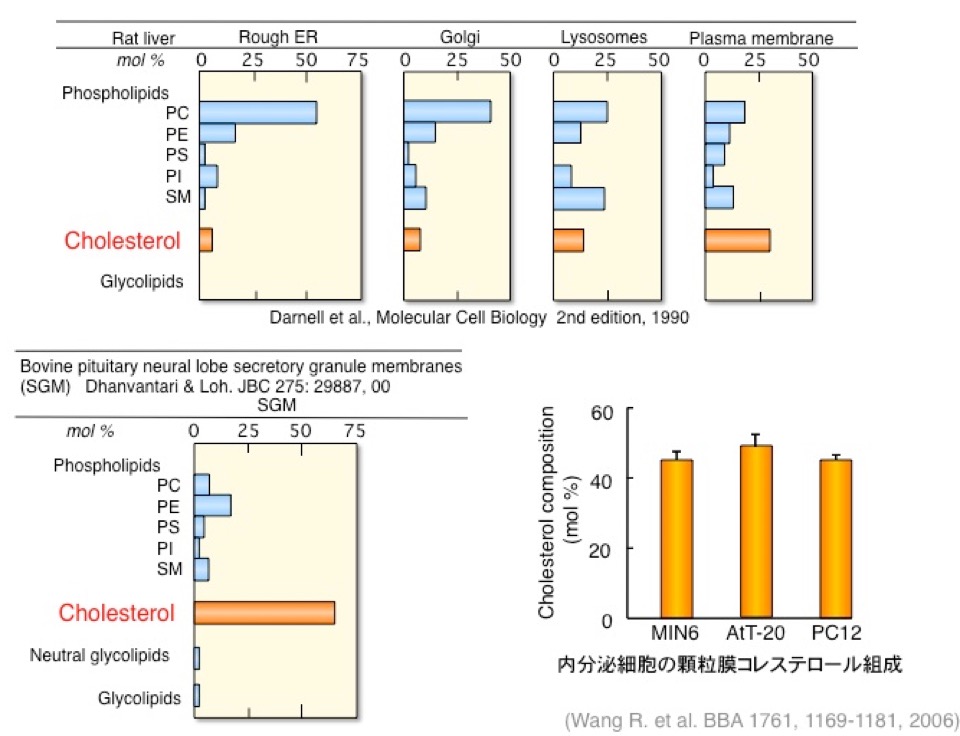
図4. 細胞内オルガネラ膜に脂質組成
分泌顆粒膜のコレステロール組成は40 mol%-65 mol%と他のオルガネラに比べて極めて高い。
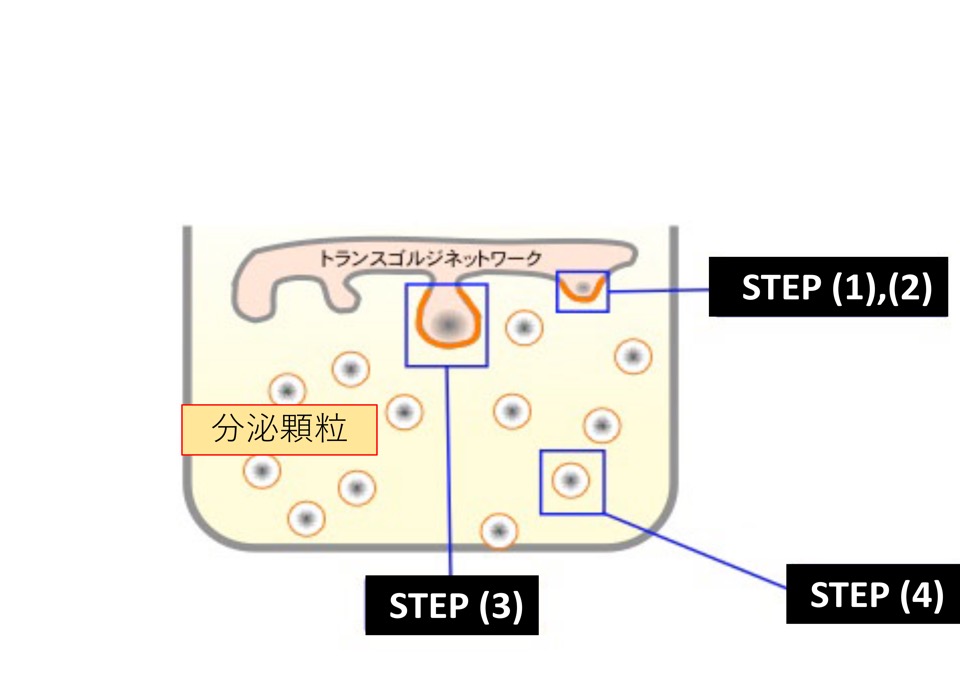
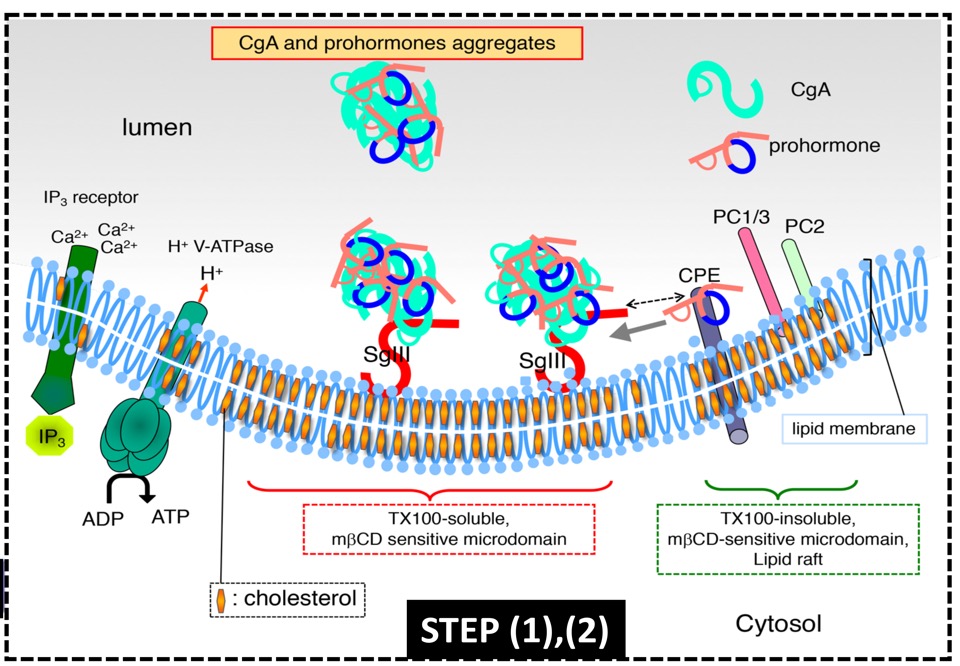
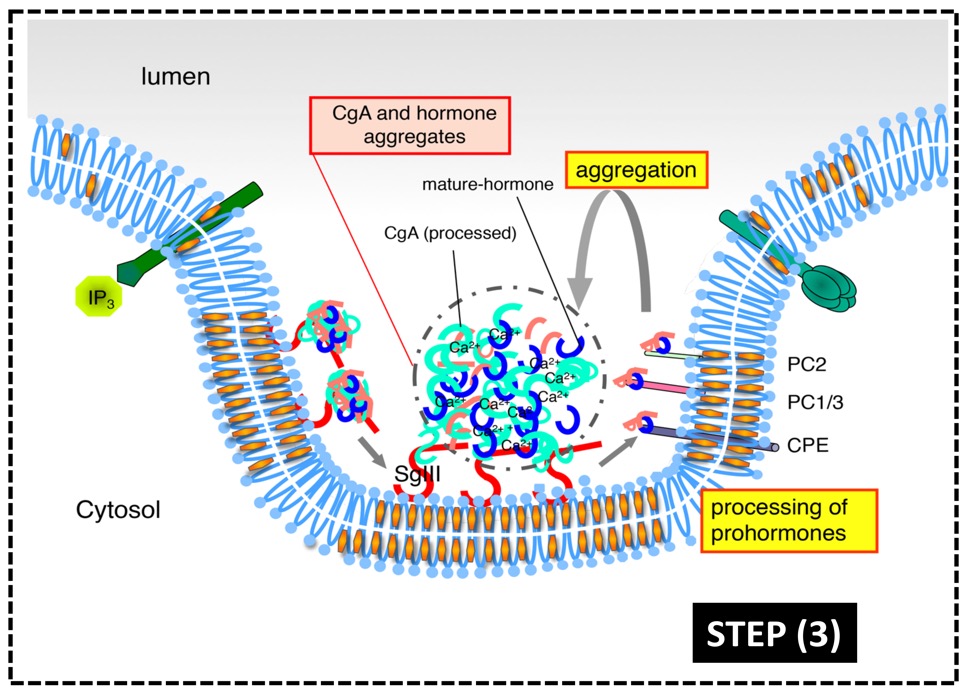
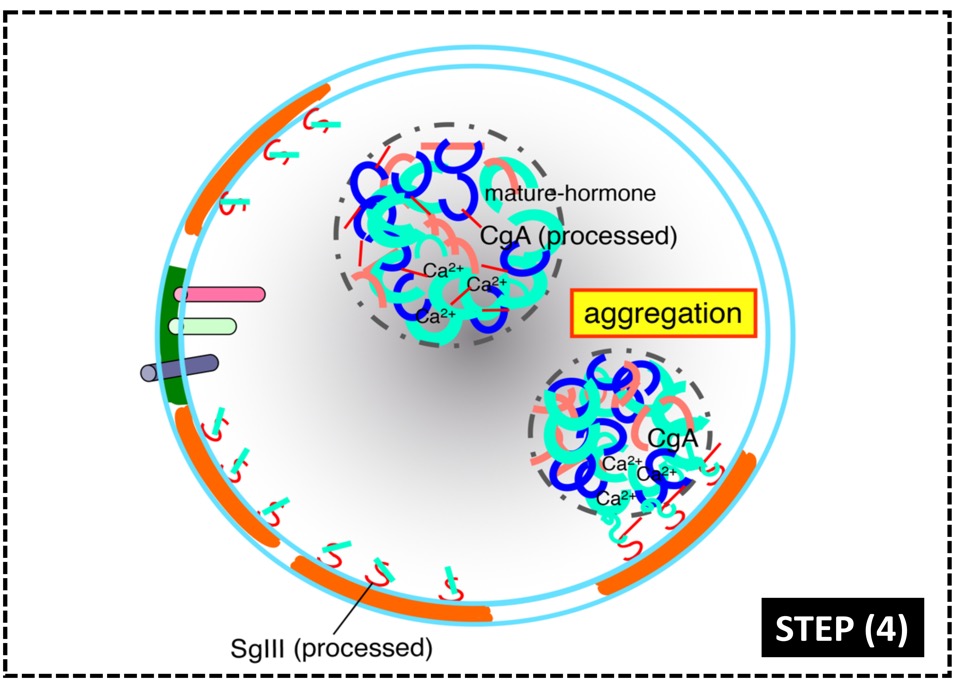
図5. 高コレステロールドメインを基盤とする分泌顆粒の形成機序
(1) 高コレステロールドメインにセクレトグラニンⅢ(SgIII)、カルボキシペプチダーゼE(CPE)が結合する。
(2) ホルモンを結合したクロモグラニンA(CgA)がセクレトグラニンⅢに結合する。
(3) プロセシング酵素(PC1/3, PC2)によってホルモン前駆体が活性型に切断される。
(4) CgAと活性型ホルモンは顆粒内で再凝集し、顆粒膜上から顆粒内腔に移行して分泌に備える。
現在、我々(渡部剛教授:旭川医科大学;五味浩司教授:日本大学生物資源科学部獣医学科;鳥居征司准教授:群馬大学 生体調節研究所;穂坂:秋田県立大学)は研究対象を『内分泌細胞の分泌顆粒形成機構』に拡大しています。上述したように、私はペプチドホルモンが分泌顆粒に運ばれる機構を研究してきました。しかし、その分泌顆粒形成の開始点であるトランスゴルジネットワーク膜にコレステロールが集積する機構は、更なる謎として残されています。そこで、SgIIIとコレステロールが結合することを足がかりにして、1)新規コレステロール蛍光プローブを開発して内分泌細胞でコレステロールが分泌顆粒に集積する過程を可視化する、2)SgIIIを足掛かりに、分泌顆粒膜に高濃度のコレステロールが貯留するメカニズムを解明する、3)SgIII膜結合領域の三次構造解析、また 4)細胞レベル(SgIII欠損細胞:Traffic 14, 205-218, 2013)、個体レベル(J Histocem Cytochem 63, 350-356, 2015;SgIII欠損マウス:Endocrinology 159, 1213-1227, 2018;J. Histochem. Cytochem. 69, 229-243)でSgIIIの生理的役割を解明する、を研究しています。
b 生体イメージングプローブの開発
現在、我々の研究グループが取り組んでいる一連のプローブ開発は「内分泌細胞の分泌顆粒形成に果たすコレステロールの役割を解明する」研究(上記参照)に端を発しています。我々の研究グループは2007年に群馬大学大学院工学研究科に依頼して細胞内のコレステロールを可視化するプローブの開発に着手しました。このとき共同研究者になっていただいた飛田成史教授のグループが有機EL素材の研究をしており、我々は偶然、有機EL素材イリジウム錯体が低酸素状態で発光する特徴を持つことを伺いました。この経緯がイリジウム錯体を用いた「生体の低酸素領域検出プローブの発想」に至ったわけです。
群馬大学工学研究科との共同研究は多岐にわたり、現在は工学研究科の堀内准教授(奥津研究室;新規光線力学療法薬の開発;図6;Chemistry 20, 6054-6060, 14)、吉原准教授(飛田研;イリジウム錯体の改良、コレステロールプローブの作製;図7,9)、山田准教授(ペプチド・生体材料研究室;コレステロールプローブ作製、セクレトグラニンIII の構造解析)、森口准教授(篠塚研究室;コレステロールプローブ作製、新規生体プローブ;Chemistry Letters 38, 966-967, 09;Endocrinology 151, 4705-4716, 2010)と学際的アプローチをしております。異分野との共同研究は生物学・生命科学研究の面白みと奥深さを再認識させてくれています。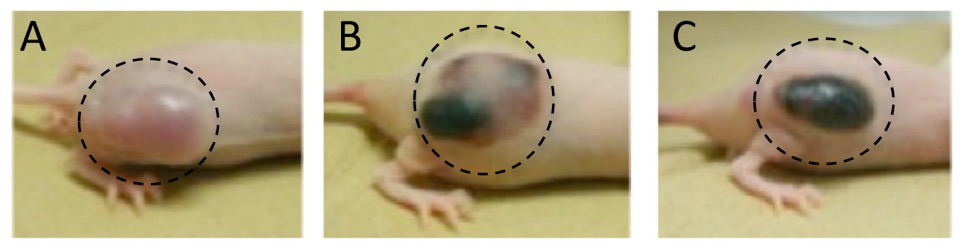
図6. 光線力学療法薬の比較
(A)無投与、(B) 既存治療薬、(C) 開発中治療薬
•破線サークル内が腫瘍部分。
•腫瘍の黒色部位はネクローシスを起こしている。
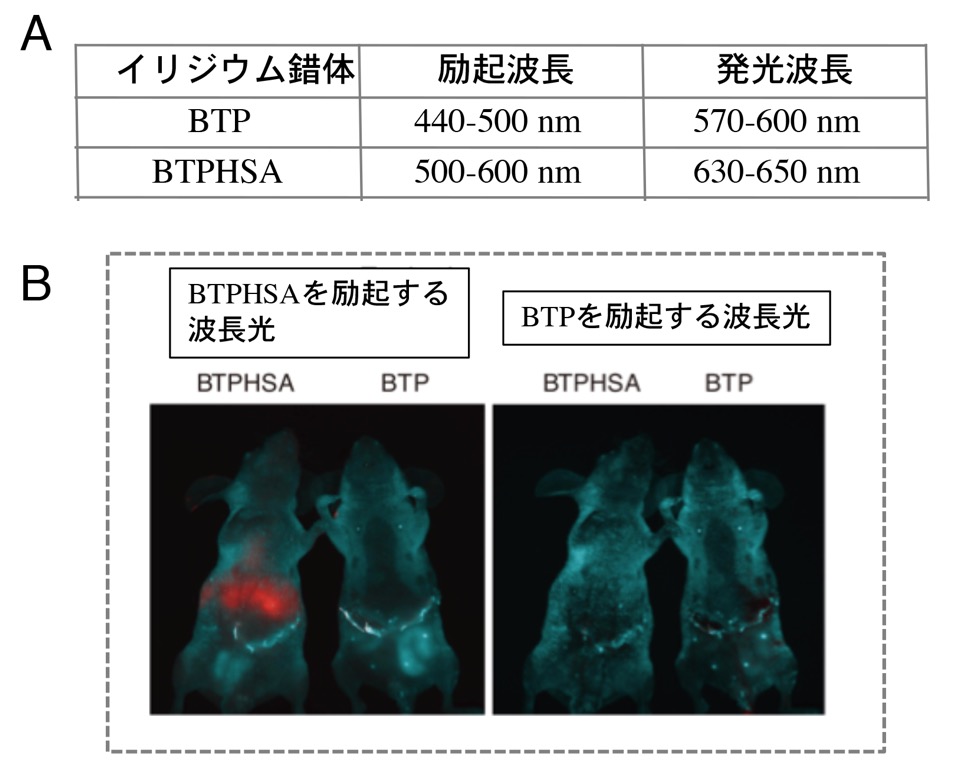
図7. BTP長波長改良体BTPHSA
(A)BTPとBTPHSAの至適励起波長と発光波長.
(B) マウス肝臓裏に移植した腫瘍(移植深度1 cm;腫瘍サイズ1-2mm)のイメージング。
Note. BTPHSAはBTPより深部腫瘍をイメージングできる。
c 有機EL素材イリジウム錯体による低酸素病態イメージング技術の実用化
生体内の低酸素状態は、がん、脳・心筋梗塞等の病態組織で観察され、我が国の3大死因:がん、脳卒中、心筋梗塞の基本病態となっております。この低酸素状態を検出する方法としては、放射性アイソト−プ (RI) 標識したプローブ(ニトロイミダゾール、Cu-ATSM、F-deoxyglucose)を病巣に集積させてPET (Positoron Emission Tomography) で検出する方法が知られております。しかしPET診断は生体の高深度領域をイメージングできる一方で、病巣へのプローブ集積に時間がかかり、プローブの代謝、排出経路も描写されて病巣診断の障害となります。またPET診断には放射線管理区域に設置する高額の装置が必要で、検査は大掛かりとなります。
近年、我々の研究グループは低酸素病態に焦点を当て、その超早期診断に向けて、簡便で安価な分子イメージング技術の確立を目指しています。我々が提案する低酸素組織イメージング法は、がん、動脈硬化、脳梗塞、心筋梗塞部位が正常組織に比べて低酸素状態にあることに着目し、低酸素環境下でのみ発光するイリジウム錯体を生体に投与し、そのリン光を利用して低酸素病態を検出する全く新しいタイプの分子イメージング法です。
これまでに我々は、イリジウム錯体BTPを用いて、その赤色リン光を低酸素下(5%酸素濃度)で培養したがん細胞(図8)とヌードマウスに移植した腫瘍で観察しました(図7, 9)。つまりイリジウム錯体は低酸素病態のイメージングプローブとして有用であることを確認しています(Cancer Reserch, 70,4490-4498, 10)。
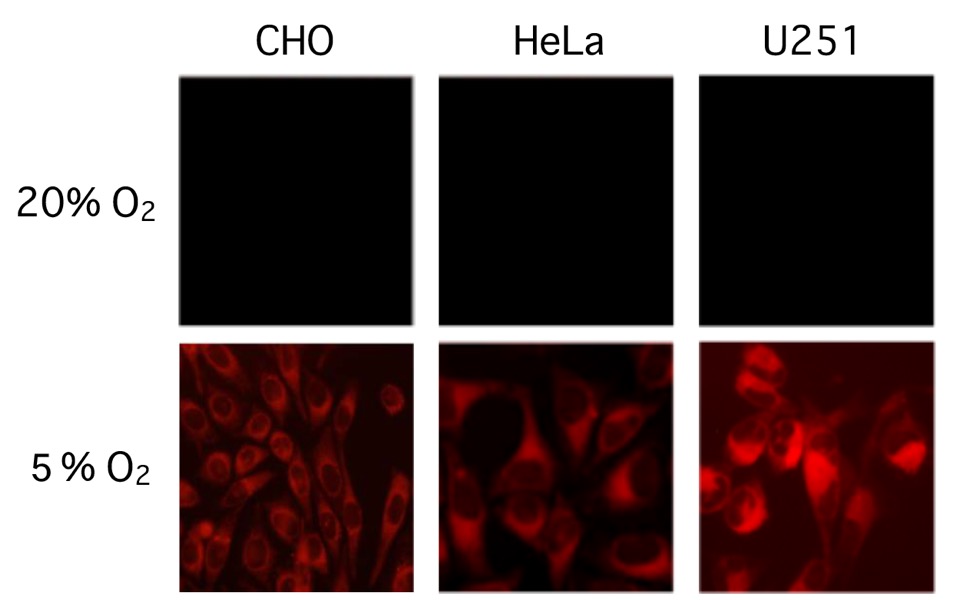
図8. 培養細胞でのBTPシグナル
BTP発光は20%の酸素濃度(一般的な培養条件)では観察できないが
酸素濃度5%にすると観察できる。
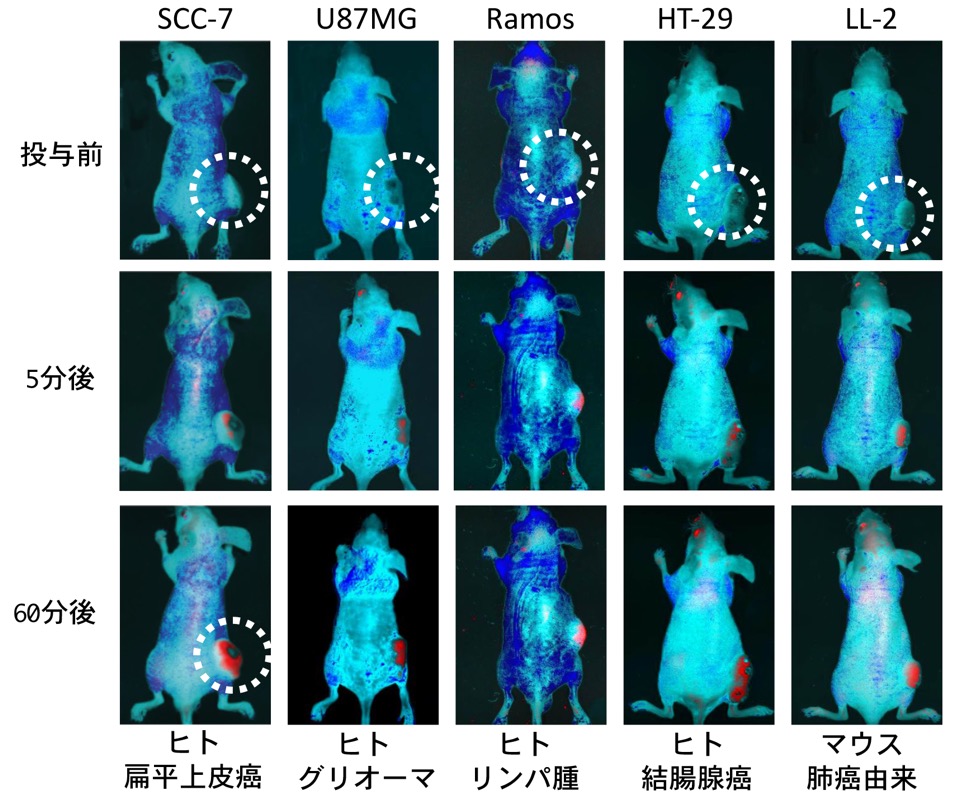
図9. 腫瘍マウスでのBTPシグナル
ヌードマウスに口腔扁平上皮がん、グリオーマ、リンパ腫、大腸がん、肺がん細胞を移植して腫瘤を作った。
尾静脈からイリジウム錯体BTP250 nmolを静注し、in vivo イメージングシステム マエストロ(CRI社;励起波長445-490 nm、検出波長 >580 nm)で観察した。
どのタイプの腫瘍も静注5分後には赤色発光を得、1時間後には腫瘍全体の鮮明な画像を得た。
*破線サークルは腫瘍部
現在は実用化に向けてイリジウム錯体の改良、検出モデルの提案(Angew Chem Int Ed Engl. 51, 4148-4151, 2012)、安全性の検証(これまで細胞レベル、マウスレベルで毒性は観察されていない)を行っています(Journal of Photochemistry and Photobiology C: Photochemistry Reviews. 30, 71-95, 2017)。
本研究で開発されるプローブとその投与技術は外科、一般内科、循環器内科、眼科、健康診断といった医学分野で簡便、安価に低酸素病態を発見できるので国民の健康維持に大きく寄与すると期待して研究を行っています。
d 内分泌細胞の酸素応答
我々は、低酸素病態を可視化するプローブの開発過程(上記b, cの研究)で、酸素濃度測定技術を含め生体深部および局所の酸素環境に不明な点が多いことを経験し、またイメージングモデル作成の過程でマウス胎児が子宮内で予想以上の低酸素環境に曝されながらも発達・成長するのを目の当たりにし、『生体におけるホルモン分泌は常酸素より低い酸素濃度に適応した機構で調節されているのでは?』との着想を得て、研究を進めている(Biochemical Journal 476, 827-842, 2019)。本研究課題では、これまでの「内分泌細胞に関する研究」と「酸素を利用した生体プローブの開発」と云った二つの方向性の研究成果を組み合わせることにより、これまで見過ごされてきた内分泌機能調節系固有の酸素応答の分子機構について、細胞から個体レベルまで広範囲にわたる新たな知見を加えることを期待しています。
2. 業績
発表論文
2025
Kikuchi S, Odashima K, Yasui T, Torii S, Hosaka M, Gomi H.: Dominant Expression of Chromogranin B in Pituitary Corticotorophs and Its Putative Role in Interaction with Secretogranin III. J. Histochem. Cytochem. 73, 29-53
2024
Yasui T., Mashiko M., Obi A., Mori H., Ito-Murata M., Hayakawa H., Kikuchi S., Hosaka M., Kubota C., Torii S., Gomi H.; Insulin granule morphology and crinosome formation in mice lacking the pancreatic-specific β cell specific phogrin (PTRN2) gene. Histochem. Cell Biol. Cytochem. 161, 223-238
Kubota C., Torii R., Hosaka M., Takeuchi T., Gomi H., Torii S.; Phogrin Regulates High-Fat Diet-Induced Compensatory Pancreatic β-Cell Growth by Switching Binding Partners. Nutrients 16,169.
Gomi H., Nagumo T., Asano K., Konosu K., Yasui T., Torii S., Hosaka M.; Differential expression of secretogranin II and III in canine adrenal chromaffin cells and pheochromocytomas. J. Histochem. Cytochem. 70, 335-356
Gomi H., Hinata A., Yasui A., Torii S., Hosaka M.; Expression Pattern of the LacZ Reporter in Secretogranin III Gene-trapped Mice. J. Histochem. Cytochem. 69, 229-243
Sato E., Maeda Y., Sato Y., Hinata A., Gomi H., Koga D., Torii S., Watanabe T., Hosaka M.; Culture in 10% O2 enhances the production of active hormones in neuro-endocrine cells by up-regulating the expression of processing enzyme. Biochemical Journal 476, 827-842
Torii S., Kubota C., Saito N., Kawano A., Hou N., Kobayashi M., Torii R., Hosaka M., Kitamura T., Takeuchi T., Gomi H.; The pseudophosphatase phogrin enables glucose-stimulated insulin signaling in pancreatic β-cells. J. Biol. Chem. 293, 5920-5933
Maeda Y., Kudo S., Tsushima K., Sato E., Kubota C., Kayamori A., Bochimoto H., Koga D., Torii S., Gomi H., Watanabe T., Hosaka M.; Impaired processing of prohormones in secretogranin III null mice causes maladaptation to an inadequate diet and stress. Endocrinology 159, 1213-1227.
Gomi H., Osawa H., Uno R., Yasui T., Hosaka M., Torii S., Tsukie A.; Canine Salivary glands; analysis of Raw and SNARE protein expression and SNARE complex formation with diverse tissue properties. J. Histocem. Cytochem. 65, 637-653
Yoshihara T., Hirakawa Y., Hosaka M., Nangaku M., Tobita S.; Oxygen imaging of living cells and tissues using luminescent molecular probes. Journal of Photochemistry and Photobiology C: Photochemistry Reviews. 30, 71-95
Nakazawa N., Sato A., Hosaka M.; TORC1 activity is partially reduced under nitrogen starvation conditions in sake yeast Kyokai no. 7, Saccharomyces cerevisiae. J Biosci. Bioeng. 121, 247-252.
Sato S., Nakazawa M., Kihara Y., Kubo Y., Sato Y., Kikuchi T., Nonaka A., Sasaki A., Iwashita J., Murata J., Hosaka M., Kobayashi M.; Partial inhibition of differentiation associated with elevated protein levels of pluripotency factors in mouse embryonic stem cells expressing exogenous EGAM1N homeoprotein. J. Biosci. Bioeng. 120, 562-569.
Gomi H., Morikawa S., Shinmura N., Moki H., Yasui T., Tsukise A, Torii S., Watanabe T., Maeda Y., Hosaka M.; Expression of secretogranin III in chicken endocrine cells: its relevance to the secretory granule properties of peptide prohormone processing and bioactive amine content. J. Histochem. Cytochem. 63, 350-3566.
Yoshihara T., Hosaka M., Terata M., Ichikawa K., Murayama S., Tanaka A., Mori M., Itabashi H., Takeuchi K., Tobita S.; Intracellular and in vivo oxygen sensing using phosphorescent Ir(III) complexes with a modified acetylacetonato ligand. Anal. Chem. Anal. Chem. 87, 2710-2717
Yoshihara T., Murayama S., Masuda T., Kikuchi T., Yoshida K., Hosaka M., Tobita S.; Mitochondria-targeted oxygen probes based on cationic iridium complexes with a 5-amino-1, 10-phenanthroline ligand. Journal of Photochemistry and Photobiology A: Chemistry 299 , 172–182..
Horiuchi H., Hosaka M., Mashio H., Terata M., Ishida S., Kyusin S., Okutsu T., Takeuchi T., Hiratsuka H.; Silylation Improves the Photodynamic Activity of Tetraphenylporphyrin Derivatives In Vitro and In Vivo. Chemistry 20, 6054-6060.
Watanabe, T., Bochimoto, H., Koga, D., Hosaka, M., Ushiki, T.; Functional Implications of the Golgi and Microtubular Network in Gonadotropes. Mol Cell Endocrinol. 385, 88-96.
Watanabe, T., Bochimoto, H., Koga, D., Hosaka, M., Ushiki, T.; Functional Implications of the Golgi and Microtubular Network in Gonadotropes. Mol Cell Endocrinol. pii: S0303-7207(13)00443-7
Sato S., Morita S., Iha M., Mori Y., Sugawara S., Kasuga K., Kojima I., Ozaki N., Muraguchi H., Okano K., Iwashita J., Murata J., Hosaka M., Kobayashi M.; Intact structure of EGAM1 homeoproteins and basic amino acid residues in the common homeodomain of EGAM1 and EGAM1C contribute to their nuclear localization in mouse embryonic stem cells. J. Biosci. Bioeng. 116, 141-146
Tsuchiya, M., Manabe Y., Yamada, K., Furuichi, Y., Hosaka, M., Fujii, N.; Chronic exercise enhances insulin secretion ability of pancreatic islets without change in insulin content in non-diabetic rats. BBRC 430, 676-682
Sun, M., Watanabe, T., Bochimoto, H., Sakai, Y., Torii, S., Takeuchi, T., Hosaka, M.; Multiple sorting systems for secretory granules ensure the regulated secretion of peotide hormones. Traffic 14, 205-218
Watanabe, T., Sakai, Y., Koga, D., Bochimoto, H., Hira, Y., Hosaka, M., Ushiki, T.; A unique ball-shapeed Golgi apparatus in the rat pituitary ganadotrope: its functional implications in relation to the arrangement of microtuble network. J. Histochem. Cytochem. 60, 588-602
Yoshihara, T., Yamaguchi, Y., Hosaka, M., Takeuchi, T., Tobita, S.: Ratiometric Molecular Sensor for Monitoring Oxygen Levels in Living Cells. Angew Chem Int Ed Engl. 51, 4148-4151.
Yoshihara. Y., Kobayashi, A., Oda, S., Hosaka, M., Takeuchi, T., Tobita, S.: Iridium Complex Probes for Monitoring of Cellular Oxygen Levels and Imaging of Hypoxic Tissues. Proc. SPIE 8233, 82330A1-82330A8
Horiuchi, H., Kameya, T., Hosaka, M., Yoshimura, K., Kyushin, S., Matsumoto, H., Okutsu, T., Takeuchi, T., Hiratsuka, H. : Silylation Enhancement of Photodynamic Activity of Tetraphenylporphyrin Derivative. J. Photochem. Photobiol. 221, 98-104.
Yamaguchi, R., Hosaka, M., Torii, S., Hou, N., Saito, N., Yoshimoto, Y., Imai., H., Takeuchi, T.: Cyclophilin C-associated protein regulation of phagocytic functions via NFAT activation in macrophages. Brain Res. 1397, 55-65.
Saito, N., Takeuchi, T., Kawano, A., Hosaka, M., Hou, N., Torii, S.: Luminal Interaction of Phogrin with Carboxypeptidase E for Effective Targeting to Secretory Granules. Traffic 12, 499-506.
Tsuchiya, M., Hosaka, M., Moriguchi, T., Zhang, S., Suda, M., Yokota-Hashimoto, H., Shinozuka, K., Takeuchi, T. (The first two authors contributed equally to this work.): Cholesterol Biosynthesis Pathway Intermediates and Inhibitors Regulate Glucose-stimulated Insulin Secretion and Secretory Granule Formation in Pancreatic beta-Cells. Endocrinology 151, 4705-4716
Zhang, S., Hosaka, M., Yoshihara, T., Negishi, K., Iida, Y., Tobita, S., Takeuchi, T. (The first three authors contributed equally to this work.): Phosphorescent Light-emitting Iridium Complexes Serve as a Hypoxia-sensing Probe for Tumor Imaging in Living Animals. Cancer Reserch, 70,4490-4498.
Hosaka M, Watanabe T: Secretogranin III: a bridge between core hormone aggregates and the secretory granule membrane. Endocrine J. 57, 275-286
Moriguchi, T., Hosaka, M., Yosinari, A., Ozaki, A., Takeuchi, T., Shinozuka, K.: Cholesterol Analogs Labeled with Novel Silylated Fluorescent Compounds. Chemistry Letters 38, 966-967
Hotta, K., Hosaka, M., Tanabe, A., Takeuchi, T. (The first two authors contributed equally to this work.): Secretogranin II Binds to Secretogranin III and Forms Secretory Granules with Orexin, Neuropeptide Y and Proopiomelanocortin. J. Endocrinol. 202, 111-121
Yoshihara, T., Karasawa, Y., Zhang, S., Hosaka, M., Takeuchi, T., Iida, Y., Endo, K., Imamura, T., Tobita, S.: In-Vivo Phosphorescence Imaging of Cancer Using Iridium Complexes. Proc. SPIE 7190, 71900X1-71900X9
Han, L., Suda, M., Tsuzuki, K., Wang, R., Ohe, Y., Hirai, H., Watanabe, T., Takeuchi, T., Hosaka, M.: A large form of secretogranin III functions as a sorting receptor for chromogranin A aggregates in PC12 cells. Mol. Endocrinol. 22, 1935-1949
Hou, N., Torii, S., Saito, N., Hosaka, M., Takeuchi, T.: Reactive Oxygen Species-Mediated Pancreatic beta-Cell Death Is Regulated by Interactions between Stress-Activated Protein Kinases, p38 and c-Jun N-Terminal Kinase, and Mitogen-Activated Protein Kinase Phosphatases. Endocrinology. 149, 1654-1665
Takeuchi, T., Hosaka, M.: Sorting Mechanism of Peptide Hormones and Biogenesis Mechanism of Secretory Granules by Secretogranin III, a Cholesterol-Binding Protein, in Endocrine Cells. Curr. Diabetes Rev. 4, 31-38
Kitahara, K., Sakai, Y., Hosaka, M., Hira, Y., Kakizaki, H., Watanabe, T.: Effects of a depot formulation of the GnRH agonist leuprorelin on the ultrastructure of male rat pituitary gonadotropes. Arch Histol Cytol. 70, 79-93
Hosaka, M., Watanabe, T., Yamauchi, Y., Sakai, Y., Suda, M., Mizutani, S., Takeuchi, T., Isobe, T., Izumi, T.: A subset of p23 localized on secretory granules in pancreatic beta-cells. J. Histochem. Cytochem. 55, 235-245
Wang, R., Hosaka, M., Han, L., Yokota-Hashimoto, H., Suda, M., Mitsushims, D., Torii, S., Takeuchi, T.: Molecular probes for sensing the cholesterol composition of subcellular organelle membranes. Biochim. Biophys. Acta. 1761, 1169-1181
Hosaka, M., Watanabe, T., Sakai, Y., Kato, T., Takeuchi, T.: Interaction between secretogranin III and carboxypeptidase E facilitates prohormone sorting within secretory granules. J. Cell Science 118, 4785-4795
Sakai Y, Hosaka M, Hira Y, Watanabe T.: Addition of phosphotungstic acid to ethanol for dehydration improves both the ultrastructure and antigenicity of pituitary tissue embedded in LR White acrylic resin. Arch Histol Cytol. 68, 337-347
Aihara, M., Sugawara, K., Torii, S., Hosaka, M., Kurihara, H., Saito, N., Takeuchi, T.: Angiogenic Endothelium-specific Nestin Expression is enhanced by the First Intron of the Nestin Gene. Lab. Invest. 84, 1581-1592
Sakai, Y., Hosaka, M., Yoshinaga, A., Hira, Y., Harumi, T., Watanabe, T.: Immunocytochemical localization of secretogranin III in the endocrine pancreas of male rats. Arch Histol Cytol. 67, 57-64
Fujisawa, T., Kamimura, H., Hosaka, M., Torii, S., Izumi, T., Kuwano, H., Takeuchi, T.: Functional localization of proprotein-convertase furin and its substrate TGF in EGF receptor-expressing gastric chief cells. Growth Factors 22, 51-59
Hosaka, M., Suda, M., Sakai, Y., Izumi, T, Watanabe, T., Takeuchi, T.: Secretogranin III binds to cholesterol in the secretory granule membrane as an adapter for chromogranin A. J. Biol. Chem. 30, 3627-3634
Zhang, B., Hosaka, M., Sawada, Y., Torii, S., Mizutani, S., Ogata, M., Izumi, T., Takeuchi, T.: PTHrP induces insulin expression through activation of MAP kinase-specific phosphatase-1 that dephosphorylates c-jun N-terminal kinase in pancreatic beta-cells. Diabetes 52, 2720-2730
Sakai, Y., Hosaka, M., Hira, Y., Harumi, T., Ohsawa, Y., Wang, H., Takeuchi, T., Uchiyama, Y., Watanabe, T.: Immunocytochemical localization of secretogranin III in the anterior lobe of male rat pituitary glands. J. Histochem. Cytochem. 51, 227-238
Hosaka, M., Watanabe, T., Sakai, Y., Uchiyama, Y., Takeuchi, T.: Identification of a chromogranin A domain that mediates binding to secretogranin III and targeting to secretory granules in pituitary cells and pancreatic -Cells. Mol. Biol. Cell 13, 3388-3399
Yi, Z., Yokota, H., Torii, S., Aoki, T., Hosaka, M., Zhao, S., Takata, K., Takeuchi, T., Izumi, T.: The rab27a/granuphilin complex regulates the exocytosis of insulin-containing dense-core granules. Mol. Cell. Biol. 22, 1858-1867
2000
- Zhang, W., Li, J.L., Hosaka, M., Janz, R., Shelton, J.M., Albright, G.M., Richardson, J.A., Südhof, T.C., Victor, R.G.: Cyclosporine A-induced hypertension involves synapsin in renal sensory nerve endings. Proc. Natl. Acad. Sci. 97, 9765-9770
Hosaka, M., Hammer, R.E., Südhof, T.C.: A phospho-switch controls the dynamic association of synapsins with synaptic vesicles. NEURON 24, 377-387
Dulubova, I., Sugita, S., Hill, S., Hosaka, M., Fernandez, I., Südhof, T.C., Rizo, J.: A conformational switch in syntaxin during exocytosis: role of munc18. EMBO J. 18, 4372-4382
Hosaka, M., Südhof, T.C.: Homo- and heterodimerization of synapsins. J. Biol. Chem. 274, 16747-16753
1998
Hosaka, M., Südhof, T.C.: Synapsin III, A novel synapsin with an usual regulation by Ca2+. J. Biol. Chem. 273, 13371-13374
Esser, L., Wang, C.-R., Hosaka, M., Smagulla, C.S., Südhof, T.C. Deisenhofer, J.: Synapsin I is structually Similar to ATP-utilizing enzymes. EMBO J. 17, 977-984
- Hosaka, M., Südhof, T.C.: Synapsin I and II are ATP-binding proteins with differential Ca2+ regulation. J. Biol. Chem. 273, 1425-1429
1996
- Hosaka, M., Toda, K., Takatsu, H., Watanabe. T., Banno, T., Ikehara, Y., Murakami, K., Nakayama, K.: Differential effects of Brefeldin A on intracellular localization of ADP-ribosylation factors type 1 to type 6 (ARF1-ARF6) cloned from mouse. J. Biochem. (Tokyo) 120, 813-819
- Hosaka, M., Murakami, K., Nakayama,K.: PACE4A is a ubiquitous endoprotease that has similar but not identical substrate specificity to other Kex2-like processing endoproteases. Biomed. Res. 15, 383-390
- Kako, K., Munekata, E., Hosaka, M., Murakami, K., Nakayama,K.: Cloning and Sequence Analysis of mouse cDNAs Encoding Preprotachykinin A and B. Biomed. Res. 14, 253-259
- Nakagawa, T., Hosaka, M., Torii, S., Watanabe, T., Murakami, K., Nakayama, K.: Identification and Functional Expression of a New Member of the Mammalian Kex2-like Processing Endoprotease Family: Its Striking Structural Similarity to PACE4. J. Biochem. (Tokyo) 113, 132-135
1992
Nakayama, K., Watanabe, T., Nakagawa, T., Kim, W.S., Nagahama, M., Hosaka, M., Hatsuzawa, K., Kondoh-Hashiba, K., Murakami, K.: Consensus Sequence for Precursor Processing at Mono-arginil Sites; Evidence for the involvement of a Kex2-like endoprotease in precursor cleavages at both dibasic and mono-arginil sites. J. Biol. Chem. 267, 16335-16340
Nakayama, K., Kim, W.S., Torii, S., Hosaka, M., Nakagawa, T., Ikemizu, J., Baba, T., Murakami, K.: Identification of the fourth member of mammalian endoprotease family homologous to the yeast Kex2 protease. J. Biol. Chem. 267, 5897-5900
Hosaka, M., Nagahama, M., Kim, W.S., Watanabe, T., Hatsuzawa, K., Ikemizu, J., Murakami, K., Nakayama, K.: Arg-X-Lys/Arg-Arg motif as a signal for precursor cleavage catalyzed by furin within the constitutive secretory pathway. J. Biol. Chem. 266, 12127-12130
Nakayama, K., Hosaka, M., Hatsuzawa, K., Murakami, K.: Cloning functional expression of a novel endoprotease involved in prohormone processing at dibasic sites. J. Biochem. (Tokyo) 109, 803-806
Hatsuzawa, K., Hosaka, M., Nakagawa, T., Nagase, M., Showda, A., Murakami, K., Nakayama, K.: Structure and expression of mouse furin, a yeast-related protease; Lack of processing of coexpressed prorenin in GH4C1 cells. J. Biol. Chem. 265, 22075-22078
総説
古市泰郎、山田健一朗、土屋美穂、穂坂正博、眞鍋康子、0藤井宣晴:継続的なトレーニングは膵β細胞のインスリン分泌能を高める、体力科学63(1), 93, 2014
飛田成史、吉原利忠、穂坂正博、竹内利行:りん光分子プローブを用いた癌環境イメージング−低酸素の可視化、Medical Science Digest 35, 538-541, 2009.
渡部 剛、阪井裕子、平義樹、暮地本宙己、穂坂正博:内分泌細胞における分泌顆粒形成機構、顕微鏡 43:29-34, 2008
穂坂正博: ホルモンが分泌顆粒へ選別されるメカニズム、生化学(社団法人生化学) 79, 166-170, 2007
著書
北村忠弘、北川浩史、穂坂正博、小島至 著;生活習慣病最前線;上毛新聞社・ 2012年
小島至、伴野祥一、竹内利行、柴田宏、穂坂正博、久保原禅、山西哲郎、樋口剛、高橋久仁子 著;群馬に多い病気(担当章:コレステロールは悪ものか?);上毛新聞社・ 2007年
群馬大学教員による共著;新時代への視点(担当章:コレステロールと分泌顆粒);上毛新聞社・2006年
特許
特許10報
特願7報
その他活動歴
セミナー(市民講座など):
- タイトル:癌を探す〜癌を光らせる薬剤の開発〜(大学コンソーシアムあきた主催)(2012年7月7日)
- タイトル:がんを光らせる薬剤の開発(地域貢献シンポジウム;群馬大学主催)(2010年12月25日)
- タイトル「ここでしか聞けない話が満載!!〜医学・科学の話題あれこれ:がんの早期発見に向けて〜群大発診断薬の開発〜」(まちなかキャンパス;前橋商工会議所主催)(2010年11月11日)
- タイトル「知って得する医学・科学の話いろいろ;『がん』を探す ~新規診断薬の開発~」(まちなかキャンパス;前橋商工会議所主催)(2009年12月2日)
- タイトル「群馬に多い病気~生活習慣病を知り、克服する;がんの超早期診断に向けて~新規診断薬の開発~」(まちなかキャンパス;前橋商工会議所主催)(2008年11月12日)
寄稿(一般市民に向け):
- 「生活習慣病の超早期診断に向けて」商工まえばし(2008年8月1日)
- 「コレステロールは悪ものか?」上毛新聞(2005年8月29日)
科学研究費など
(研究テーマ、実施期間、資金制度名)
- セクレトグラニンに依存しない分泌顆粒へのホルモン選別機構を探索する、令和6-8年度、令和6年度科学研究費補助金・基盤研究(C)
- ホルモン前駆体と活性化酵素が出会う仕組み:グラニンを介した共輸送機構の解明、令和3-5年度、令和3年度科学研究費補助金・基盤研究(C)
- 内分泌細胞の酸素応答とホルモン生合成・分泌制御のクロストークを解明する、平成30-令和2年度、平成30年度科学研究費補助金・基盤研究(C)
- イリジウム錯体の特性を活かしてNash病態を描出する新規整体イメージング技法の確立、平成28-29年度、平成28年度科学研究費補助金・挑戦的萌芽研究
- 神経内分泌細胞の高コレステロール組成膜に結合するタンパク質を探索する、平成25-27年度、平成25年度科学研究費補助金・基盤研究(C)
- 転移がんをイメージングして転移がん研究モデルを確立する、平成24-26年度、学長プロジェクト研究(重点プロジェクト;秋田県立大学)
- ヒト生体イメージングを目指した革新的バイオフォトニクス技術の構築、平成23-28年度、JST産学共創基盤研究
- イリジウム錯体の光線力学療法薬としての可能性を検証する、平成23-24年度、JST A-STEP
- 神経内分泌細胞のコレステロール代謝とホルモン分泌調節のクロストークを解明する、平成22-24年度、平成22年度科学研究費補助金・基盤研究(C)
- 低酸素癌組織イメージング用発光プローブの開発、平成21-23年度、JST要素技術プログラム
- イリジウム錯体を用いた低酸素病態イメージング技術の実用化、新学術領域(研究課題提案型)、平成21-23年度
- 低酸素病態イメージング技術の実用化、平成21年度、JSTシーズ発掘試験
- 神経内分泌細胞のコレステロール輸送を基盤とした神経様小胞と分泌顆粒の形成機構、平成18,19年度、平成18年度科学研究費補助金・基盤研究(C)
- 神経内分泌細胞の調節性分泌経路へのタンパク質選別輸送機構の解明、平成16,17年度、平成16年度特定領域研究(公募研究)、
- 調節性分泌経路へのタンパク質選別機構について、平成15,16年度、平成15年度科学研究費補助金・基盤研究(C)
- 神経小胞および内分泌顆粒の開口放出において小胞上蛋白質シナプシンが果す機能の解析、平成13,14年度、平成13年度科学研究費補助金・基盤研究(C)
- シナプス小胞開口分泌における小胞上蛋白質シナプシンの新しい役割、平成11,12年度、平成11年度科学研究費補助金・基盤研究(C)
所属学会
- 日本分子生物学会
- 日本生化学会
- 日本細胞生物学会
- 日本分子イメージング学会
- 日本下垂体研究会
- 北関東医学会
- The Endocrine Society 会員
学内委員
秋田県立大学:教務委員(副委員長2011年度-2013;委員長2014-2018)、FD委員(2011-2013;学部委員長 2013)、RI研究施設運営委員(2013-)、動物実験委員(2018-2024;委員長2018-2024);研究倫理委員(2013-)、2012, 2024年度入学学生担当、入学対策委員(2018-2024;委員長2020-2024)、応用生物科学科長(2025-)XXX委員(2018ー
釣り同好会顧問(実績をかわれたのでしょうか?;会の皆さんへ:怪我が無いようにお願いします。)


サクラマス(冬) サクラマス(夏)

イトウ


レイクトラウト イナダ(ブリの幼魚)


ソゲ(ヒラメの幼魚;40cm未満) ヒラメ


ダツ マゴチ

鰆


ブラックバス 雷魚
他大学; 群馬大学:広報戦略室員(2009-2011):客員教授(2011年度 - 2016年度);秋田大学:(手形地区)ヒトを対象とした研究倫理審査委員(2011-);中通総合病院:研修管理委員(2015-)
